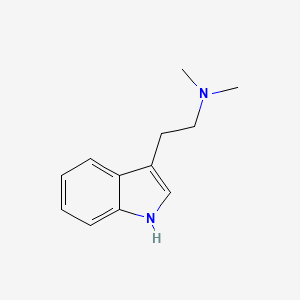
DMT, AFFINITA’ RECETTORIALI
E’ un cliché tipico del riduzionismo farmacologico associare gli effetti psichedelici del DMT e degli altri allucinogeni classici all’agonismo sul recettore 5HT2A della serotonina, perchè diversamente da altri non si desensibilizza all’azione farmacologica della molecola combaciando con la mancanza dello sviluppo di una tolleranza.
Tuttavia è ormai ben documentato come ci siano tanti altri target ugualmente importanti. Per esempio l’affinità del DMT il 5HT1A, che filtra fino all’80% della serotonina cerebrale per regolare il fenomeno percettivo, è anche più altra di quella per l’altro recettore e ne influenza l’azione drasticamente. Anche il legame con 5HT2C e TAAR è comune in tutte le sostanze psichedeliche e potrebbe avere un ruolo di primaria importanza.
Andando nel dettaglio il DMT interagisce con una vasta varietà di recettori ionotropici e metabotropici [1].
–Recettori serotoninergici (5ht7, 5ht1d, 5ht2b, 5ht2c, 5ht1e, 5ht6, 5ht5a, 5ht2a, 5ht1a, 5ht1b)
E’ più selettivo verso i 5ht2 che non per gli altri.
Attiva l’idrolisi dei fosfoinositidi causando un aumento concentrazione-dipendente nella produzione di inositol fosfati in maniera simile alla stessa setonina (hanno simile struttura chimica) [2].
Secondo la maggior parte degli autori i principali effetti allucinogeni sarebbero spiegati dall’antagonismo sul recettore 5ht2a, perchè diversamente da altri non si desensibilizza all’azione farmacologica del DMT combaciando con la mancanza dello sviluppo di una tolleranza [3].
L’agonismo sul recettore 5ht1a ha effetti opposti all’antagonismo sul recettore 5ht2a, da una ricerca si evince che la soppressione di questo recettore potenzia gli effetti in maniera simile ma estranea all’inibizione dell’enzima MAO [4].
-Recettori adrenergici (Alpha2B, Alpha2C, Alpha1B, Alpha2A, Alpha1A, Beta1, Beta2)
Si lega a questi recettori con conseguente modulazione simpaticoadrenergica caratterizzata da midriasi, ipertermia, lieve tachicardia ed ipertensione.
-Recettori dopaminergici (D1,D4, D5, D2, D3)
Alla dose di 20 mg/ml (IV) ha stimolato la sintesi della dopamina nel corpo striato dei ratti senza incrementarne i livelli per via del parallelo aumento del turnover centrale extraneuronale di questo neurotrasmettitore [5].
In un altra ricerca lo stesso dosaggio indotto una diminuzione della concentrazione di dopamina nel presencefalo del 42% che indicherebbe un aumento nel rilascio di questo neurostrasmettitore [6].
Questo fenomeno potrebbe essere dovuto all’azione del DMT sul MAO-A, dove si comporta come un potente inibitore a breve durata, associata alla liberazione delle riserve di dopamina dai depositi presinaptici.
L’incremento nell’attività dopaminergica potrebbe anche spiegare gli effetti avversi della sostanza sui casi di psicosi e schizofrenia.
-Recettore I1 dell’imidazolina
E’ responsabile della depressione del CNS che si manifesta con effetti opposti a quelli indotti dalla stimolazione adrenergica (ipotermia, bradicardia, ipotensione): meccanismo che potrebbe spiegare gli sbalzi termici e cardiovascolari indotti dalla sostanza.
Non si sa molto sull’azione specifica del DMT di questi recettori che sono più selettivi per le betacarboline.
-Trasportatori monoaminici (SERT, VMAT2)
Agisce come un substrato per SERT e VMAT2 inibendone l’attività [7].
-Recettori Sigma (-1, -2)
E’ un antagonista di questi recettori su cui agisce anche come modulatore endogeno.
Dati sperimentali dimostrano che il legame causa l’inibizione dei canali del sodio voltaggio dipendenti nelle cellule dei miociti inducendo ipermobilità nelle cavie [8].
-Recettori dei cannabinoidi (CB1, CB2)
Il DMT attiva questi recettori anche se è molto meno selettivo di THC e cannabinoidi, non si sa molto della sua azione specifica.
Si è visto che l’assunzione di THC incrementa il rilascio di melatonina e secondo alcune ricerche alti livelli di quest’ormone sono correlati alla produzione endogena del DMT e all’attività della ghiandola pineale.
Inoltre lo stesso THC agisce come un inibitore di MAO-A e MAO-B, anche se non è molto potente.
Questi fattori potrebbero spiegare il classico flashback che induce la cannabis anche a giorni di distanza dall’esperienza allucinogena vera e propria.
Dai report aneddotici si evince che il consumo di cannabis pre-DMT attutisca l’esperienza riducendone l’intensità, mentre il consumo post-peak la incrementi.
-Recettori oppiodi (KOR, DOR MOR)
Non è ben chiaro il suo ruolo su questi recettori, ma da dati sperimentali si evince che dosi leggere di oppiodi agiscano come antagonisti selettivi del DMT riducendone gli effetti generali [9].
-Recettori muscarinici dell’acetilcolina (M1, M2, M3, M4, M5)
Ha una bassa affinità per questi recettori: non altera i livelli di acetilcolina nella corteccia ma riduce significativamente la concentrazione di questo neurotrasmettitore nel corpo striato.
Ciò suggerisce che gli interneuroni colinergici di quest’area dispongano di recettori per le triptamine allucinogene sotto controllo del sistema serotoninergico eccitatorio [6].
-Recettori dell’istamina (H2, H1)
Ha un affinità molto bassa per questi recettori, agisce come antagonista contribuendo a modulare lo stato di eccitabilità neuronale.
-Recettori TAAR-1
Agisce come agonista ad alta affinità per questo recettore, ha causato l’attivazione dell’adenil ciclasie e il conseguente l’accumulo di cAMP nelle cellule HEK293 [10].
Non si sa come questo fenomeno influenzi gli effetti allucinogeni del DMT, ma alcuni autori ipotizzano che possa contribuire agli effetti visivi della sostanza rispetto ad altri agonisti serotoninergici come il 5-MeO-DMT che hanno maggiore affinità per il 5-HT2a ma scarsa per il TAAR-1.
FARMACOLOGIA DMT
Gli effetti generali delle dosi allucinogene esogene risultano in un aumento nei livelli di serotonina in circolo; sono mediati dai recettori serotoninergici (5-HT2A principalmente) e modulati dai glutammatergici (mGlu2/3 principalmente).
La significativa attività dopaminergica (anche se indiretta) influenza gli effetti comportamentali della sostanza.
Quando viene somministrato per via intravenosa agisce in 2m e dura circa 30m, una dose threshold è intorno ai 0.2 mg/kg [11].
Alcuni studi scientifici documentano lepotenzialità farmacologiche della combinazione MAO-I + DMT su diversi tipi di dipendenza farmacologica [12], comportamenti violenti, delinquenza [13], disturbo da stress post-traumatico [14].
Ma rispetto ad altre molecole psichedeliche più note, come la psilocibina, la ricerca su questa sostanza è ancora agli albori.
FONTI
1)Ray, Thomas S. “Psychedelics and the human receptorome.” PloS one 5.2 (2010).
2)Rabin, Richard A., et al. “5-HT2A receptor-stimulated phosphoinositide hydrolysis in the stimulus effects of hallucinogens.” Pharmacology Biochemistry and Behavior 72.1-2 (2002).
3)Smith, Randy L., et al. “Agonist properties of N, N-dimethyltryptamine at serotonin 5-HT2A and 5-HT2C receptors.” Pharmacology Biochemistry and Behavior 61.3 (1998).
4)Deliganis, Anna V., Pamela A. Pierce, and Stephen J. Peroutka. “Differential interactions of dimethyltryptamine (DMT) with 5-HT1A and 5-HT2 receptors.” Biochemical pharmacology 41.11 (1991).
5)Smith, Thomas L. “Increased synthesis of striatal dopamine by N, N-dimethyltryptamine.” Life sciences 21.11 (1977).
6)Haubrich, Dean R., and Paulina FL Wang. “N, N-dimethyltryptamine lowers rat brain acetylcholine and dopamine.” Brain research 131.1 (1977).
7)Cozzi, Nicholas V., et al. “Dimethyltryptamine and other hallucinogenic tryptamines exhibit substrate behavior at the serotonin uptake transporter and the vesicle monoamine transporter.” Journal of neural transmission 116.12 (2009).
8)Fontanilla, Dominique, et al. “The hallucinogen N, N-dimethyltryptamine (DMT) is an endogenous sigma-1 receptor regulator.” Science 323.5916 (2009).
9)Ruffing, Diane M., and Edward F. Domino. “Interaction of synthetic opioid metenkephalin peptide analogs, lilly 127623 and FK 33-824 with indole hallucinogens: Antagonism of N, N-dimethyltryptamine-and LSD-induced disruption of food-rewarded bar pressing behavior in the rat.” Psychopharmacology 80.4 (1983).
10)Barker, Steven A. “N, N-Dimethyltryptamine (DMT), an endogenous hallucinogen: past, present, and future research to determine its role and function.” Frontiers in neuroscience 12 (2018).
11)Strassman, Ruck J., et al. “Dose-response study of N, N-dimethyltryptamine in humans: II. Subjective effects and preliminary results of a new rating scale.” Archives of general psychiatry 51.2 (1994).
12)Fernández, Xavier, and Josep María Fábregas. “Experience of treatment with ayahuasca for drug addiction in the Brazilian Amazon.” The therapeutic use of ayahuasca. Springer, Berlin, Heidelberg, 2014.
13)Frecska, E. “Ayahuasca versus violence–a case report.” Neuropsychopharmacologia Hungarica: a Magyar Pszichofarmakologiai Egyesulet lapja= official journal of the Hungarian Association of Psychopharmacology 10.2 (2008)..
14)Nielson, Jessica L., and Julie D. Megler. “Ayahuasca as a candidate therapy for PTSD.” The therapeutic use of ayahuasca. Springer, Berlin, Heidelberg, 2014.